«Beba suco de laranja, faz bem porque contém vitamina C!» A maioria das pessoas provavelmente já ouviu esse ou um comando semelhante na infância. A vitamina C, também conhecida como ácido ascórbico ou ácido L-ascórbico, é um nutriente essencial que os humanos não conseguem produzir por si próprios. Contamos com fontes externas, como frutas e vegetais frescos, para obtê-lo. Como a vitamina C tem propriedades antioxidantes, também é frequentemente usada como conservante de alimentos. Este artigo do blog abordará a história da vitamina C e alguns dos diferentes métodos analíticos usados para determinar a vitamina C em vários produtos.
Use a navegação abaixo para ir diretamente para uma seção específica.

A história da vitamina C está bem ligada à temida doença do escorbuto, que costumava ser a principal causa de morte entre os marinheiros. Vasco da Gama já tinha notado os efeitos curativos dos citrinos e as autoridades recomendaram o uso de sumo de limão ou outros alimentos vegetais para prevenir o escorbuto.
No entanto, em 1747, foi o médico naval britânico James Lind quem confirmou, numa experiência controlada, que as frutas cítricas poderiam prevenir o escorbuto. No experimento, Lind agrupou doze marinheiros com gravidade semelhante de escorbuto em pares e tratou cada par de maneira diferente. Durante duas semanas, os participantes do estudo receberam cidra, elixir de vitríolo (uma mistura de ácido sulfúrico e álcool), vinagre, água do mar, uma pasta feita de alho, sementes de mostarda e outras especiarias, além de um copo de água de cevada, ou duas laranjas e um limão. Apenas a dupla que recebeu laranjas e limões foi curada [1]. Como resultado, a Marinha Britânica ordenou que todos os seus navios transportassem um fornecimento constante de suco feito de limões europeus. O que Lind não sabia era que as propriedades medicinais das frutas cítricas se deviam ao seu alto teor de vitamina C.
Nos séculos seguintes, os alimentos que eram conhecidos por prevenir o escorbuto foram chamados antiescorbútico, derivado da palavra latina medieval para escorbuto: «scorbutus». Além das frutas cítricas, esses alimentos incluíam, por exemplo, o chucrute, que James Cook usou em sua longa viagem ao Havaí.

Em 1912, Casimir Funk introduziu o conceito de vitaminas como componentes essenciais da dieta. O chamado fator antiescorbútico logo foi considerado como «C solúvel em água». A vitamina C foi isolada pela primeira vez das glândulas supra-renais de animais em 1928 pelo cientista húngaro Albert Szent-Györgyi. Ele chamou essa substância de ácido hexurônico e suspeitou que fosse o fator antiescorbútico que prevenia o escorbuto.
Foi em 1932 que Szent-Györgyi e Joseph Svirbely concluíram que o ácido hexurônico era de fato vitamina C. O mesmo havia sido confirmado apenas algumas semanas antes por Charles G. Rei nos EUA. Possivelmente, isso ocorreu porque Svirbely enviou uma carta ao seu antigo mentor, King, anunciando a descoberta. Uma disputa acirrada sobre prioridade ocorreu nos anos seguintes [2].
Valter N. Haworth identificou a estrutura química da vitamina C em 1933. Ele e Szent-Györgyi propuseram que o ácido L-hexurônico fosse nomeado a-escórbico ácido («a» significa não em latim e «escorbuto» referindo-se ao escorbuto) devido à sua função antiescorbútica. Em parte por esta descoberta, Albert Szent-Györgyi e Walter Norman Haworth receberam os Prêmios Nobel de Fisiologia e Medicina e Química de 1937, respectivamente.
Uso atual de vitamina C
Hoje, a nossa ingestão necessária de vitamina C é geralmente coberta pelas frutas e vegetais frescos que consumimos. Além disso, a vitamina C está disponível como suplemento dietético e como medicamento barato de venda livre (OTC). É também utilizado como conservante alimentar em produtos como pão, compotas, vinho ou mesmo carnes, pois as suas propriedades antioxidantes evitam que os alimentos se estraguem. A vitamina C é designada com os números E E300–E305 para o próprio ácido, bem como para diferentes sais e ésteres de ascorbato.
Os sais de ascorbato também são utilizados em cosméticos e produtos de higiene pessoal, onde atuam como antioxidantes e retardam a degradação do produto. O ácido ascórbico também é usado na produção de fotos, purificação de água, fabricação de plástico e microscopia de fluorescência [3].
Para garantir a qualidade dos produtos farmacêuticos e cumprir as leis de rotulagem de alimentos, é necessário determinar o teor de vitamina C nos alimentos e nos produtos farmacêuticos. A próxima seção apresentará algumas maneiras diferentes pelas quais a vitamina C pode ser determinada em diversas matrizes.
Análise de vitamina C por titulação
A vitamina C é frequentemente analisada por meio de titulação, com 2,6-diclorofenolindofenol (DCPIP) ou iodo comumente usados como titulantes. Ambos os titulantes sofrem uma reação redox com ácido ascórbico. Ácido ascórbico (C6H8Ó6) é oxidado em ácido desidroascórbico (C6H6Ó6), enquanto DCPIP ou iodo é reduzido a DCPIPH2 ou iodeto, respectivamente. figura 1 mostra a equação de reação para a titulação de ácido ascórbico com DCPIP.
Para sucos de frutas sem polpa, a determinação pode ser realizada diretamente, sem qualquer preparo de amostra. Para sucos com polpa, alimentos sólidos e outros produtos à base de frutas e vegetais, primeiro deve-se extrair o ácido ascórbico.
Para evitar a oxidação do ácido ascórbico antes da titulação, o ácido metafosfórico é frequentemente adicionado à amostra. O ponto final da titulação pode ser determinado fotometricamente ou bivoltametricamente.
A titulação fotométrica com DCPIP aproveita o fato de que o DCPIP é rosa salmão, enquanto o DCPIPH2 é incolor. A titulação de iodo utiliza amido como indicador, que fica preto-azulado com excesso de iodo. Ao usar um sensor fotométrico como o Optrodo, o ponto final pode ser determinado de forma confiável para ambos os titulantes.
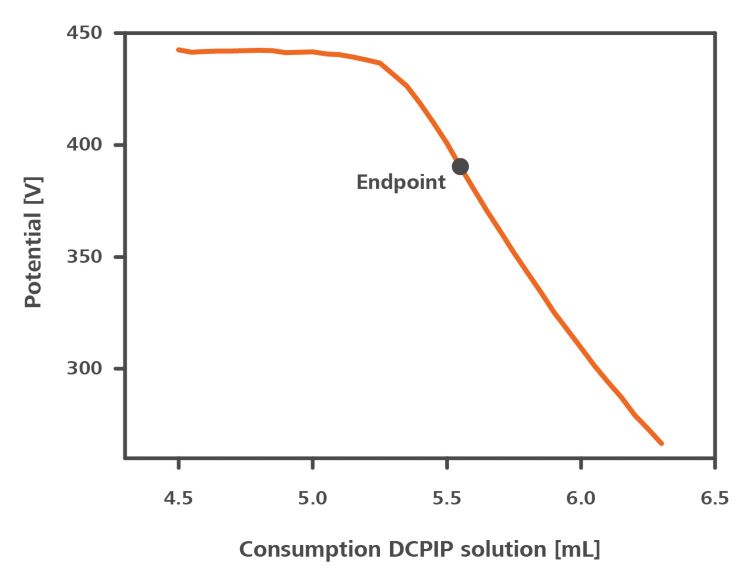
Figura 2 mostra um exemplo de curva de titulação para a titulação de ácido ascórbico em suco de laranja sanguínea com DCPIP.
Com a titulação bivoltamétrica, uma corrente é aplicada entre dois eletrodos polarizáveis no recipiente de titulação e o potencial resultante é medido. Quando o ácido ascórbico na amostra está completamente oxidado, o potencial cai abruptamente, indicando o ponto final da titulação. tabela 1 abaixo lista os documentos de aplicação disponíveis para vários tipos de amostras.
Tabela 1. Documentos de aplicação disponíveis para análise de ácido ascórbico por titulação em diferentes tipos de amostras utilizando vários titulantes.
| Amostra | Padrão | Titulante | Documento de inscrição |
|---|---|---|---|
| Sucos e preparações vitamínicas | AOAC 967.21 | DCPIP | |
| Produtos à base de frutas e vegetais | ISO 6557-2 | DCPIP | |
| Cápsulas de vitaminas e multivitamínicos, comprimidos, soluções orais | USP<580> | DCPIP | |
| Sucos e preparações vitamínicas | – | Iodo (eu2) | AN-T-162 |
| Leite em pó | – | DCPIP | AN-T-171 |
| Vinho | – | Iodato de potássio (KIO3) | AB-225 |
Determinação de vitamina C por polarografia
Alternativamente, a vitamina C pode ser analisada com alta sensibilidade por polarografia. Polarografia é um tipo de voltametria que usa um eletrodo de trabalho líquido, como um eletrodo de gota de mercúrio (DME). Durante a análise, a corrente que flui entre dois eletrodos na solução da amostra é medida à medida que a tensão aplicada aumenta gradualmente.
Durante a medição polarográfica, o ácido ascórbico é oxidado para formar ácido desidroascórbico. Sucos de vegetais e frutas podem ser analisados diretamente, enquanto comprimidos e preparações vitamínicas devem ser diluídos para criar uma alíquota de amostra adequada para medição polarográfica. Alimentos e outras amostras sólidas requerem a extração de ácido ascórbico antes da análise.
O teor de ácido ascórbico é determinado por adição de padrão, onde a amostra original é enriquecida com uma solução padrão de ácido ascórbico. Figura 3 mostra um polarograma e uma curva de calibração para a determinação de ácido ascórbico em suco de laranja. mesa 2 abaixo lista os documentos de aplicação disponíveis para diferentes tipos de amostras.
Mesa 2. Documentos de aplicação disponíveis para análise de ácido ascórbico por polarografia.
| Amostra | Documento de inscrição |
|---|---|
| Sucos de frutas e vegetais | |
| Cápsulas de vitaminas, comprimidos, soluções orais | |
| Alimentos, estimulantes e rações para animais |
Determinação de vitamina C por cromatografia iônica
A cromatografia iônica (CI) é outro método analítico válido para medir o ácido ascórbico em amostras, especialmente quando outros ácidos orgânicos (por exemplo, ácido málico, acético ou cítrico) também precisam ser analisados. A vitamina C em uma amostra é determinada como o ânion ascorbato ao usar IC. A cromatografia de exclusão iônica (IEC) é usada para separar o ascorbato de outros ânions de ácidos fracos, como citrato ou acetato.
Comprimidos, suplementos vitamínicos e aditivos alimentares podem ser analisados diretamente por IC após diluição. Para sucos contendo polpa, diálise em linha deve ser usado para remover quaisquer partículas da amostra. Esta técnica de preparação de amostras em linha é aplicada para proteger a coluna de separação e o sistema IC.
Figura 4 mostra um cromatograma para análise de ascorbato e malato em suco de frutas usando um Ácidos Orgânicos Metrosep – coluna 250/7,8, detecção de condutividade com supressão inversa (LiCl) e Metrohm Inline Dialysis para preparação de amostras. Tabela 3 abaixo lista os documentos de aplicação disponíveis para diferentes tipos de amostras.
Tabela 3. Documentos de inscrição disponíveis para a análise de ácido ascórbico por cromatografia iônica.
| Amostra | Documento de inscrição |
|---|---|
| Sucos de frutas e vegetais | AN-O-032 |
| Comprimidos de vitaminas | AN-O-007 |
| Aditivos alimentares | AN-O-024 |
Resumo
A história da vitamina C está ligada à era da navegação e das descobertas, bem como à temida doença do escorbuto. A descoberta dos benefícios das frutas cítricas por Lind estabeleceu um tratamento viável. O trabalho de Szent-Györgyi nas décadas de 1920 e 1930 levou à identificação do ácido ascórbico como vitamina C. Hoje, o escorbuto é considerada principalmente uma doença do passado distante, pois a vitamina C se tornou onipresente e facilmente disponível em frutas e vegetais frescos. Também é utilizado como nutriente de apoio à saúde e como conservante de alimentos devido às suas propriedades antioxidantes.
Titulação, voltametria e cromatografia iônica são três métodos eficazes para a análise de vitamina C em vários produtos alimentícios e farmacêuticos. Existem muito mais analitos em sucos, alimentos ou amostras farmacêuticas que podem ser analisados por essas técnicas. Confira nosso Localizador de aplicativos para encontrar a análise certa para as necessidades do seu laboratório.
Referências
[1] Hughes, R. E. James Lind e a cura do escorbuto: uma abordagem experimental. Histórico médico 1975, 19 (4), 342–351.
[2] Albert Szent-Gyorgyi. Perfis em Ciência. https://profiles.nlm.nih.gov/spotlight/wg (acessado em 09/02/2023).
[3] Ácido ascórbico. Fatos sobre segurança química. https://www.chemicalsafetyfacts.org/chemicals/ascorbic-acid/ (acessado em 01/03/2023).
 Compartilhar artigo
Compartilhar artigo
